安慰劑效應(Placebo effects)是身心相互作用的顯著證明,在疼痛感知過程中�,在沒有任何治療的情況下,對疼痛緩解的預期就可以減少疼痛體驗����,這一現(xiàn)象被稱為安慰劑鎮(zhèn)痛效應。
安慰劑效應(Placebo effects)是身心相互作用的顯著證明�,在疼痛感知過程中,在沒有任何治療的情況下���,對疼痛緩解的預期就可以減少疼痛體驗����,這一現(xiàn)象被稱為安慰劑鎮(zhèn)痛效應�����。
然而,盡管安慰劑效應的作用強大����,對人類日常體驗產生影響,且導致新療法的臨床試驗失敗��,但安慰劑效應的神經回路基礎仍然不清楚�����。
2024年7月24日��,北卡羅來納大學教堂山分校 Grégory Scherrer團隊(陳沖博士為第一作者)在國際頂尖學術期刊 Nature 上發(fā)表了題為:Neural circuit basis of placebo pain relief 的研究論文��。
該研究發(fā)現(xiàn)了安慰劑效應緩解疼痛的一個大腦神經回路——前扣帶回皮質喙部(rACC)向腦橋核(Pn)的神經元投射(rACC→Pn)�����。
此前有研究顯示����,安慰劑鎮(zhèn)痛效應與前扣帶回皮質內的活動有關�,這個腦區(qū)也與疼痛感受有關。但這種現(xiàn)象背后的生物學機制一直不明����。
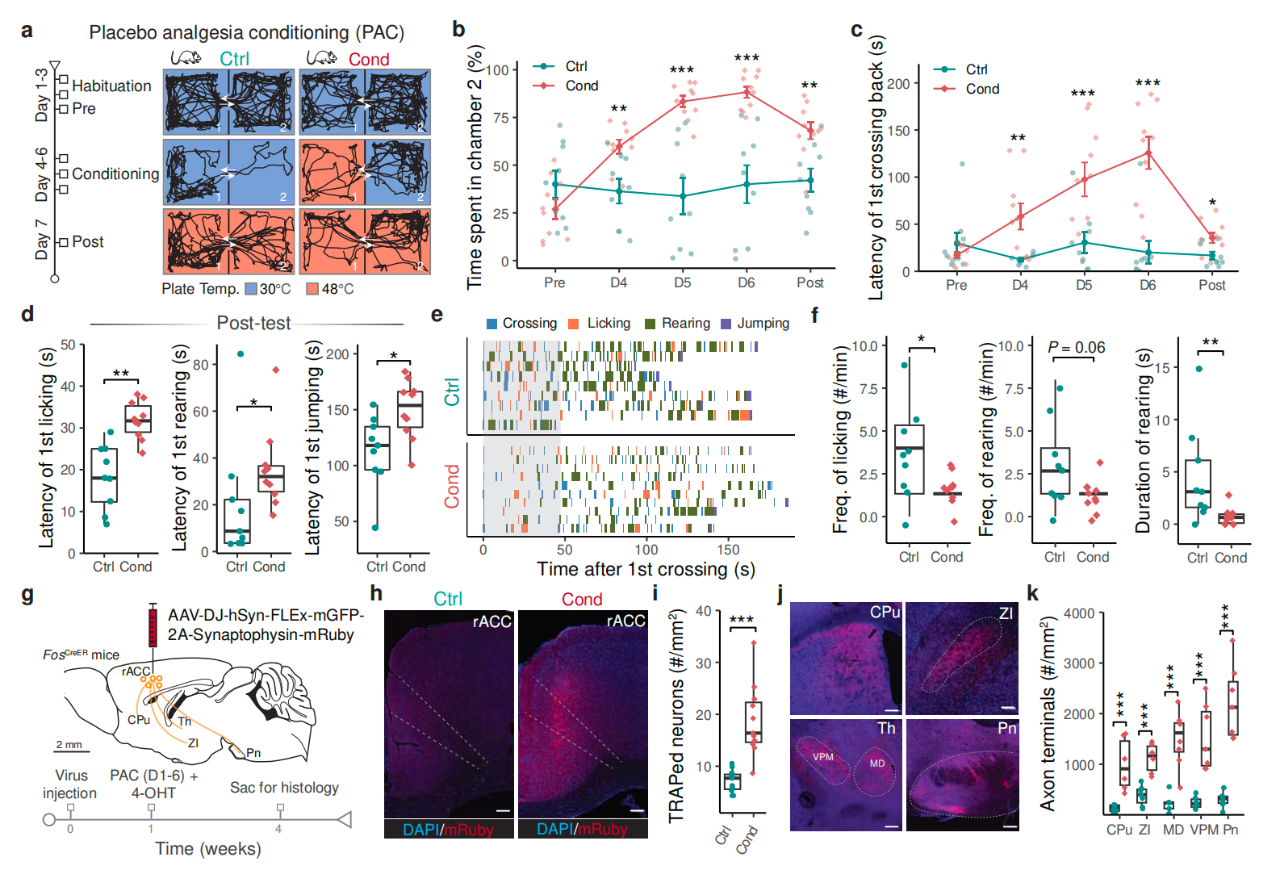
在這項最新研究中����,研究團隊設計了一個安慰劑鎮(zhèn)痛效應小鼠模型�,在小鼠中產生類似安慰劑的預期性疼痛緩解,來研究疼痛緩解是如何介導的���。研究團隊讓小鼠與地面溫度不同的兩個房間條件性相關�����,一個熱度舒適��,另一個非常熱��。這些條件性小鼠暴露在更熱的地面后�����,會在更涼的地面上停留更長時間�,說明它們預期這能緩解疼痛���,而且它們的疼痛緩解行為也會減少����,例如舔腳。
研究團隊發(fā)現(xiàn)��,由疼痛緩解預期產生的鎮(zhèn)痛作用是由前扣帶回皮質喙部(rACC)向腦橋核(Pn)的神經元投射(rACC→Pn)所介導的����,而腦橋核(Pn)此前并未被發(fā)現(xiàn)在疼痛中有作用。對神經活動的體內鈣成像和腦切片中的電生理記錄表明����,對疼痛緩解的預期會提高rACC→Pn神經元的活性,并增強該通路中的神經傳遞��。
對疼痛緩解的預期激活了rACC→Pn通路
對腦橋核(Pn)神經元的轉錄組學研究顯示����,腦橋核(Pn)中含有大量的阿片類受體,進一步表明了其在疼痛調節(jié)中的作用��。
研究團隊進一步發(fā)現(xiàn)��,抑制rACC→Pn通路會破壞安慰劑鎮(zhèn)痛作用并降低疼痛閾值��,而在沒有安慰劑條件作用的情況下激活則會引發(fā)鎮(zhèn)痛作用���。
最后�,研究團隊在小腦內發(fā)現(xiàn)了一個細胞簇——浦肯野細胞(Purkinje cell)��,這些細胞在疼痛緩解預期期間表現(xiàn)出類似于rACC→Pn神經元的活動模式�����,它們或許能編碼rACC→Pn通路中的疼痛緩解預期�,這為小腦在認知性疼痛調節(jié)中的作用提供了細胞水平的證據(jù)。
這些發(fā)現(xiàn)為使用藥物����、電極神經刺激或認知行為療法靶向前額皮質-腦橋-小腦通路來治療和緩解疼痛開辟了可能性。
論文鏈接:
https://www.nature.com/articles/s41586-024-07816-z










![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57
2006-2025 上海博華國際展覽有限公司版權所有(保留一切權利)
滬ICP備05034851號-57